2月15日,國際期刊《德國應用化學》(Angewandte Chemie International Edition)在線刊發了化學與化工學院鐘芳銳教授團隊完成的最新研究成果“拓展銅酶雜泛性催化吲哚氧化交叉偶聯反應”(Expanding Promiscuity of a Copper-Dependent Oxidase for the Enantioselective Cross-Coupling of Indoles, DOI: 10.1002/anie.202219034)。該論文報道了首例銅外排氧化酶(CueO)催化吲哚類底物的氧化交叉偶聯反應,合成了一系列光學純2,2-二取代吲哚啉-3-酮類化合物。該反應具有條件溫和、催化劑經濟、選擇性高、底物普適性好等優點,所制備的光學純吲哚3-酮衍生物ee值高達99%,并基于這些產物的生物活性篩選得到了兩個具有顯著抗腫瘤活性分子。
多銅氧化酶(MCOs)廣泛存在與自然界中,一般具有較低的底物特異性,可接納多種天然底物,其中主要類別是酚類化合物。MCOs通過單電子轉移機制催化酚的氧化反應,生成易二聚或寡聚的活性苯氧自由基,往往難以控制氧化反應中間體的下游轉化。這種性質導致單一漆酶催化酚類氧化偶聯反應的選擇性不高,易形成多種區域異構體和立體異構體的混合物,立體化學的調控往往需要借助額外的輔助蛋白,這限制了多銅氧化酶的適用范圍。
鐘芳銳團隊致力于綠色仿生和生物催化領域的研究,利用化學原理驅動酶催化選擇性合成的理念,發展了含有非天然光敏活性基團的人工光敏金屬酶(J. Am. Chem. Soc. 2021, 143, 617)和“三重態光酶”(Nature, 2022, 611, 715)。基于銅催化氧化偶聯反應的化學機制,發展了多銅氧化酶催化的多酚氧化環加成反應(Green Chem, 2022, 24, 5598.)。
針對上述問題,鐘芳銳團隊提出了“金屬催化原理驅動酶促非天然氧化交叉偶聯”的研究思路,基于銅離子的氧化還原性質,將二價銅離子的“單電子催化氧化”機制與酶的“微環境效應”相耦合,通過在酚類底物中引入額外的氫鍵供體/受體與酶的手性空腔形成有益的相互作用,成功實現了氧化偶聯反應的對映選擇性調控(圖1)。
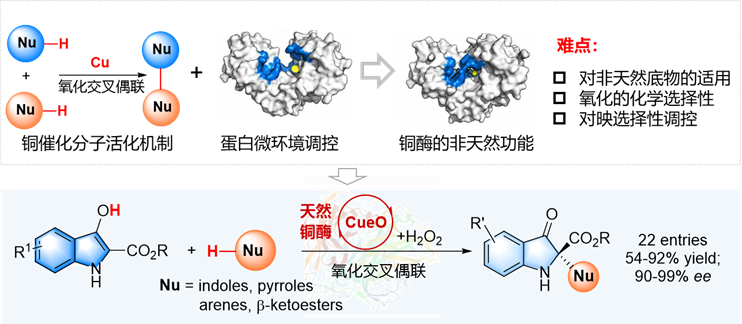
圖1. 多銅氧化酶不對稱催化氧化交叉偶聯反應的設計思路
該研究建立的酶催化不對稱交叉偶聯具有較好的底物兼容性(圖2)。苯環上含有不同電子和立體性質取代基的吲哚酚能順利發生預期反應,收率為73-78%,立體選擇性一般都為99%ee。此外,不同位置取代的吲哚親核試劑、富電子類吡咯、1,3,5-三甲氧基苯和1,3-二甲氧基苯也同樣適用。親核試劑的范圍還可以進一步擴展到sp3雜化的碳親核試劑,如環狀和非環狀β-酮酸酯,相應的產物均具有極好的立體選擇性。部分底物的放大實驗(0.3-1.0 mmol)發現,產物的產率和光學純度不受影響。
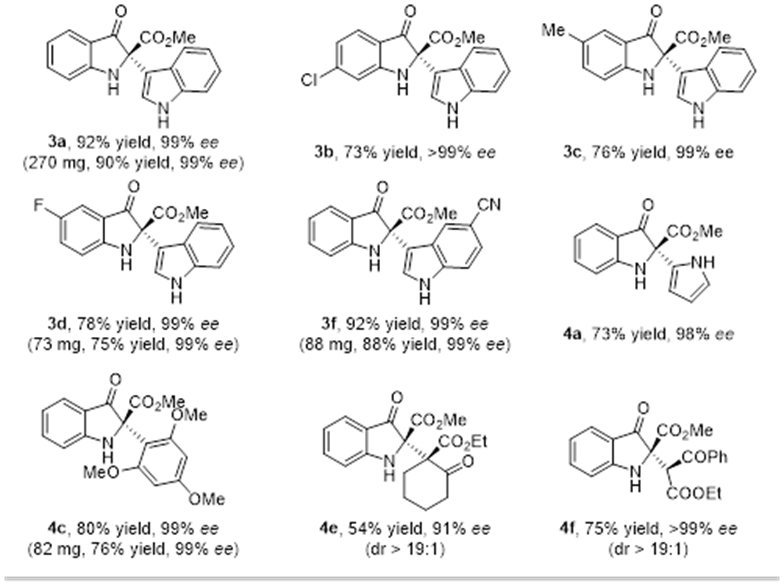
圖2. 代表性底物的結果
研究團隊對該酶促反應的機理進行了深入的研究(圖3)。首先通過控制實驗捕獲和驗證了中間體分子的生成。在此基礎上,通過銅的配位環境分析、中間體分子與酶的分子對接模擬等實驗,提出了底物與酶的可能作用模型:中間體的酯基與CueO酶Asn240的酰胺N-H和Lys188的氨基存在著弱氫鍵作用;這些相互作用可能對交叉偶聯反應的反應性和對映選擇性至關重要。當將這兩個氨基酸殘基突變成丙氨酸,所得突變體CueO_K188A和CueO_N240A的催化效果顯著降低。這一結果驗證了上述推測的酶作用方式的合理性。
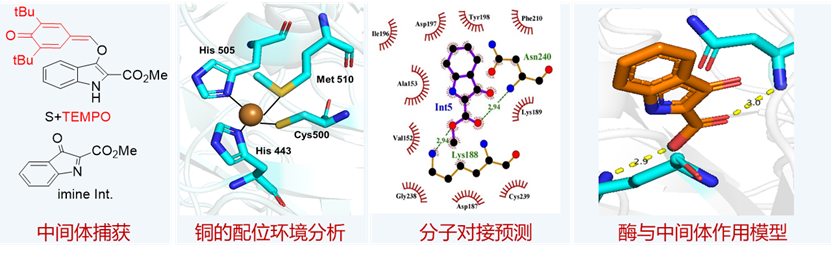
圖3. CueO酶催化的機理研究
相關文獻表明,2,2-二取代吲哚啉-3-酮類分子可能具有顯著的生物活性。作者利用MTT法測定了部分產物對MCF-7腫瘤細胞系的毒性,得到了兩個顯著抗腫瘤活性的化合物3f和4a(濃度為50μM)。隨后的詳細實驗擬合得到了兩者的IC50值分別為34.31 μM和37.2 μM,均高于臨床藥物伊立替康和5-氟尿嘧啶(圖4),具有潛在的藥物應用價值。
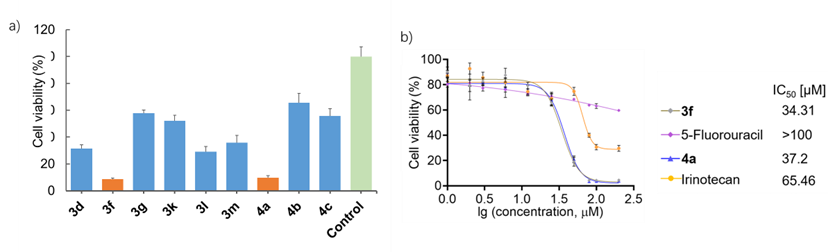
圖4. 部分化合物的細胞毒性測試
我校為論文的唯一完成單位,鐘芳銳教授是論文的唯一通訊作者。該論文第一作者為化學與化工學院2019級博士研究生郭歡。化學與化工學院2020級博士研究生孫寧寧為論文的共同第一作者。該項工作得到了國家重點研發計劃(2018YFA0903500)、國家自然科學基金(21602067)和湖北科技創新重大專項(2019ACA125)資助。
文章鏈接:https://onlinelibrary.wiley.com/doi/epdf/10.1002/anie.202219034
