9月21日,化學與化工學院鐘芳銳�、吳鈺周教授團隊與西北大學陳希教授合作的論文Enantioselective [2+2]-cycloadditions with triplet photoenzymes在《Nature》刊發����。吳鈺周、鐘芳銳和陳希為本文的共同通訊作者���,化學與化工學院博士生孫寧寧和黃建建為本文的共同第一作者,華中科技大學為該論文的第一作者單位�。


酶是自然界漫長演化形成的高效生物催化劑�,但往往僅適用于專一的底物和天然的生命化學反應�,難以滿足社會生產對多樣性功能化學品的合成需求。近年來,隨著合成生物學理論與技術的發展�,通過在蛋白中人為設計和引入非天然活性中心構建人工酶���,能夠極大地拓展酶的催化反應性���,從而實現更多樣化非天然有機化學品的生物催化合成��。雖然自然進化形成的生物酶數量和種類繁多,功能多樣����,但絕大多數都是基于熱化學驅動活化機制����。能受光驅動的天然光酶十分稀缺��,目前已經發現的光酶僅有光合作用相關的原葉綠素酸酯還原酶、修復DNA損傷的光裂合酶����、脂肪酸脫羧酶等少數幾種�。將合成化學發展的光催化劑和光催化機制融合到蛋白中構建新型人工光酶���,能突破天然酶熱催化機制的局限��,從根本上拓展生物催化的反應類型��,為重要功能化學品的綠色生物制造提供新的理論和技術。
另一方面�,手性與生命現象密切相關��,也顯著影響物質的性能。手性分子的精準合成能為醫藥、農藥�、信息和材料領域的發展提供核心技術支持�。不對稱催化是制備手性分子十分高效的途徑�����,這一領域的研究在過去半個世紀里已經取得了巨大的進展�����。然而,在激發態進行的光化學反應的手性控制仍然是一個巨大的挑戰��。
“三重態光酶”的藝術示意圖
針對上述問題���,鐘芳銳�����、吳鈺周團隊提出了“三重態光酶”的概念�,通過合成生物學前沿技術開發了一類全新的人工酶����,為激發態光反應的手性催化合成提供了一種原創性方案����。團隊基于有機合成����、基因工程��、蛋白質工程��、酶理論計算和結構生物學等交叉學科背景,將合成化學發展的二苯甲酮類優異光敏劑通過基因密碼子拓展技術定點插入到選定蛋白的手性空腔中�����,構建了含非天然催化活性中心的人工光酶TPe�。由于二苯甲酮獨特優異的三重態光物理性質,該光酶具有能量轉移催化的非天然功能和作用機制���,能催化底物從分子基態躍遷到激發態發生光反應。從化學改造構建的第一代三重態光酶TPe1.0��,團隊通過四輪突變迭代優化酶的氨基酸殘基和反應空腔結構����,建立了突變體文庫,完成了光酶的定向進化�,最終獲得了優異的突變體TPe4.0��。該光酶能高效催化吲哚衍生物的分子內[2+2]光環加成反應,所獲得的環丁烷并吲哚啉類產物具有良好的底物普適性和手性選擇性(可以獲得大于99%的單一手性異構體)。陳希團隊通過X-射線解析光酶與底物配合物的單晶結構,闡明了反應優異的手性選擇性來源于光敏劑和周邊關鍵氨基酸殘基與底物之間形成的氫鍵等多重弱鍵協同作用�����。
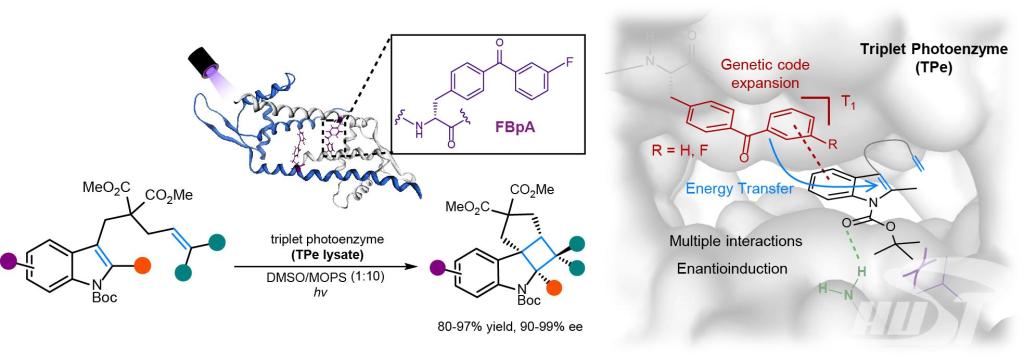
三重態光酶(TPe)催化能量轉移[2+2]光環加成反應示意圖
這項研究表明��,通過將三重態能量轉移的光催化機制與蛋白質的精細超分子腔相結合,人工三重態光酶集成了化學光催化劑的高效反應性和生物催化劑的精準選擇性兩者的優勢�,為有機分子激發態反應的手性選擇性調控提供了有效的手段���,也從根本上拓展了酶催化的反應性�����。隨著計算輔助的人工酶理性設計能力的不斷提升和基因密碼子拓展技術的進一步發展,更多結構和性質獨特的化學光敏劑將被引入蛋白創造新的非天然光酶,從而豐富光驅動生物催化的功能和應用范圍�。因此�����,研究團隊提出的“三重態光酶”這一概念有希望應用于其它更多類型的不對稱光催化反應。
該工作為鐘芳銳、吳鈺周團隊與陳希、深圳技術大學趙偉寧副教授、華中科技大學廖榮臻教授合作完成,他們分別提供了蛋白晶體解析��、蛋白質譜�����、理論計算等方面的支持���。該工作得到了國家重點研發計劃合成生物學專項�、國家自然科學基金等項目的資助�,得到了華中科技大學分析與測試中心、化學與化工學院分析與測試中心和上海同步輻射光源的儀器支持����。
該論文是吳鈺周�����、鐘芳銳團隊在化學生物學和有機合成化學交叉領域取得的突破性成果。吳鈺周長期從事蛋白質�����、核酸等天然生物大分子的化學修飾及合成生物學領域的研究��,主持了國家重點研發計劃“合成生物學”重點專項、國家自然科學基金項目����、湖北省重點研發計劃等項目�,研究方向包括非天然酶和蛋白材料的開發應用�����、核酸化學修飾及納米醫藥材料���,相關研究成果在Nature����、Chemical Review、JACS�、Angew Chem等國際權威期刊發表論文80余篇����。鐘芳銳長期從事綠色仿生有機合成領域的研究�����,主要方向包括不對稱催化和生物催化���,在Nature��、JACS、Angew Chem等期刊上發表論文50余篇����。
論文鏈接:https://www.nature.com/articles/s41586-022-05342-4
課題組鏈接:http://faculty.hust.edu.cn/zhongfangrui/zh_CN/index.htm
