4月5日,Cell子刊《化學(xué)》(Chem)在線刊發(fā)了化學(xué)與化工學(xué)院鐘芳銳教授團(tuán)隊和中科院生物物理所合作完成的最新研究成果“基因重構(gòu)人工光敏脫鹵酶全細(xì)胞催化芳鹵氫/氘化”(Whole-cell-catalyzed hydrogenation/deuteration of aryl halides with a genetically repurposed photodehalogenase, DOI: /10.1016/j.chempr.2023.03.006)。該論文報道了首例人工光酶催化的脫鹵還原反應(yīng),將廉價易得的芳鹵類化學(xué)原料一步轉(zhuǎn)化為高附加值的氘代芳烴,并且能通過基因重組的大腸桿菌進(jìn)行全細(xì)胞光生物催化,具有條件溫和、選擇性高、底物普適性廣等優(yōu)點。該研究突破了天然生物酶自然進(jìn)化形成的結(jié)構(gòu)和功能,拓展了生物催化的反應(yīng)類型和化學(xué)空間。
生物催化已經(jīng)成為可持續(xù)有機合成的重要工具。然而,人類對各種非天然化學(xué)品合成的需求與自然進(jìn)化形成的酶催化功能之間存在矛盾。例如,由于化學(xué)工業(yè)生產(chǎn)排放的一些有機鹵代物的存在,自然界逐漸進(jìn)化產(chǎn)生了降解這些污染物的細(xì)菌,在其體內(nèi)已經(jīng)鑒定了某些能編碼脫鹵酶的基因。其中,以鈷胺酰胺為輔酶的還原性脫鹵酶是一類重要的家族,能將電子從犧牲還原劑(如NADPH)轉(zhuǎn)移還原芳基或烯基鹵化物底物。然而,這些天然酶通常具有明顯的底物偏好性,僅對特定底物表現(xiàn)出催化活性。例如,NprdhA是一種從巨大芽孢桿菌pacificus pht-3B獲得的還原性脫鹵酶,僅適用于2,6-二鹵酚類底物。從合成化學(xué)的角度來看,芳香鹵化物是合成高值精細(xì)化學(xué)品的重要原料,但目前無法通過天然進(jìn)化的酶催化來實現(xiàn)。因此,開發(fā)底物普適性廣、能高值化轉(zhuǎn)化芳香鹵化物的人工酶,能突破以降解為綱、底物類型專一的天然脫鹵酶的功能限制,在合成生物學(xué)領(lǐng)域具有重要的研究意義。
鐘芳銳團(tuán)隊致力于綠色仿生和人工生物催化領(lǐng)域的研究,基于化學(xué)原理驅(qū)動酶催化選擇性合成的理念,發(fā)展了含有非天然光敏活性基團(tuán)的人工光敏金屬酶(J. Am. Chem. Soc. 2021, 143, 617)和“三重態(tài)光酶”(Nature, 2022, 611, 715),擴展了多銅氧化酶的催化雜泛性實現(xiàn)了非天然吲哚類底物的立體選擇性氧化交叉偶聯(lián)反應(yīng)(Angew. Chem. Int. Ed., 2023, e202219034)。在上述人工生物催化研究基礎(chǔ)上,團(tuán)隊深入開展化學(xué)和生物催化的交叉研究,利用基因密碼拓展技術(shù)重構(gòu)開發(fā)了含化學(xué)光催化劑的人工光敏脫鹵酶(RPDase),通過捕獲光子能量來驅(qū)動廣譜性芳香鹵化物的脫鹵氫/氘化。與金屬輔因子依賴性的天然脫鹵酶不同,RPDase通過完全非天然的光致電子轉(zhuǎn)移催化機制進(jìn)行,能利用外源性甲酸鈉為終端還原劑,從而避免了天然脫鹵酶對還原性輔酶NADPH的依賴(圖1)。
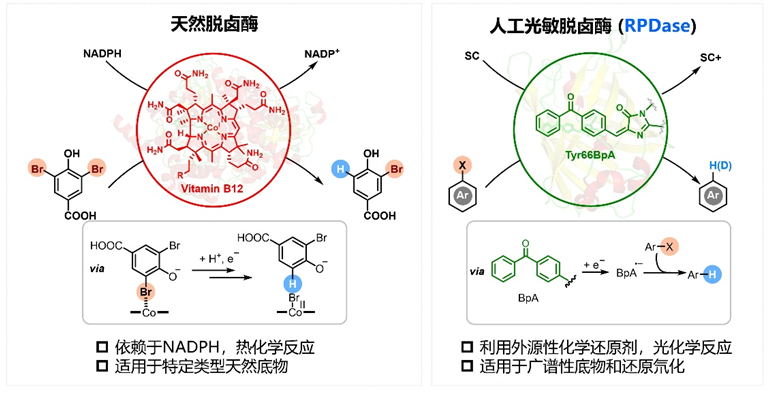
圖1.天然還原性脫鹵酶和人工光敏脫鹵酶的對比
在優(yōu)化后的反應(yīng)條件下,RPDase表現(xiàn)了較好的底物適用性(圖2)。對于吸電子基團(tuán)或供電子基團(tuán)取代的芳基溴化物、溴苯、4-溴苯胺、溴代吲哚、鹵代吡啶及雜環(huán)芳烴、氯代芳烴、碘代芳烴、多鹵素取代芳烴等30多個鹵代烴底物,RPDase均能將其轉(zhuǎn)化為芳烴。進(jìn)一步的控制實驗發(fā)現(xiàn),脫鹵還原的氫原子專一性地來源于甲酸鈉,且不受反應(yīng)液介質(zhì)影響。基于這一發(fā)現(xiàn),團(tuán)隊以氘代甲酸鈉為還原劑,發(fā)展了一種專一選擇性的生物催化脫鹵氘化反應(yīng),并成功地應(yīng)用于煙酸類似物、倍他米隆甲酯、馬尿酸甲酯、沙利度胺、溴芬酸等一系列生物活性分子的氘代衍生物的制備。
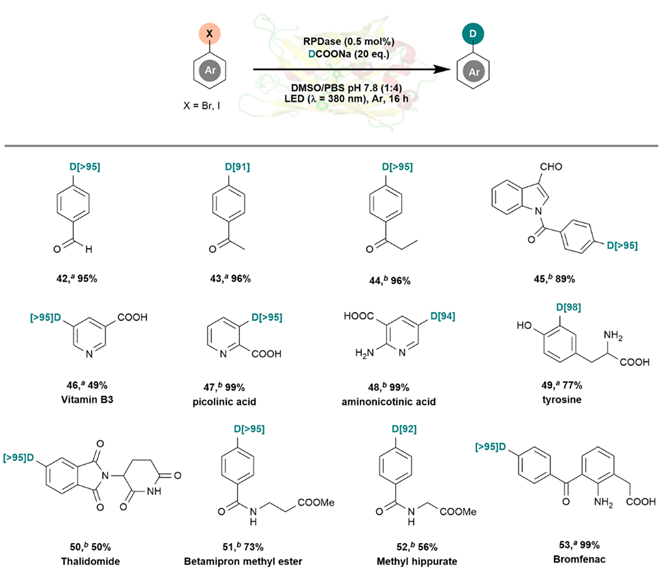
圖2. RPDase催化制備生物活性分子的氘代衍生物
團(tuán)隊對該人工光生物催化體系的酶催化機制進(jìn)行了深入探究(圖3)。通過TEMPO自由基捕獲、瞬態(tài)吸收光譜和電子順磁共振等實驗證明了芳基自由基的生成。同位素實驗表明,甲酸鈉是非常高效的終端還原劑和氫供體,氫化效率顯著高于天然還原劑抗壞血酸鈉。此外,開關(guān)燈控制實驗發(fā)現(xiàn),黑暗條件下反應(yīng)會繼續(xù)進(jìn)行,表明反應(yīng)過程中存在一定的鏈傳遞過程。基于上述實驗結(jié)果,團(tuán)隊提出了可能的光生物催化機制。在RPDase空腔微環(huán)境中,光照和甲酸鈉促使了強還原性二苯甲酮自由基陰離子和二氧化碳陰離子自由基的生成,兩者均可促進(jìn)芳基鹵化物的單電子還原生成芳基自由基,并進(jìn)一步捕獲甲酸鈉的氫原子或氘原子生成還原產(chǎn)物。
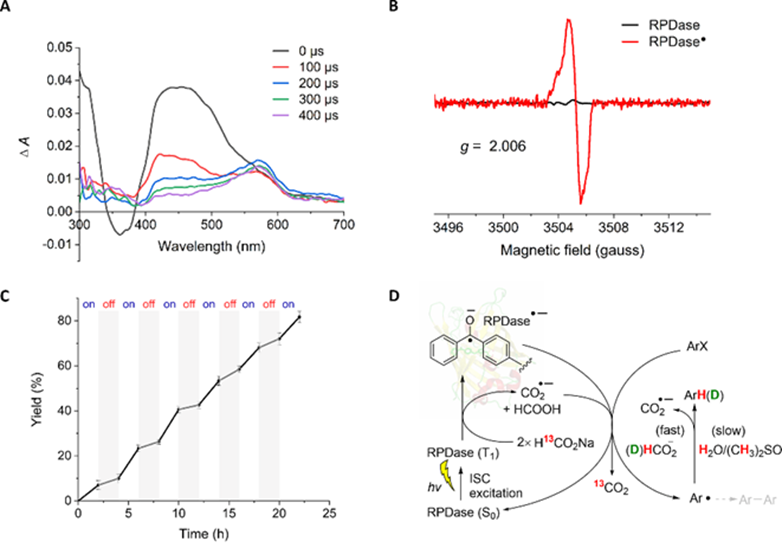
圖3 RPDase光生物催化脫鹵還原的催化機理研究
基于RPDase光催化的生物正交性和基因密碼擴展技術(shù),團(tuán)隊進(jìn)一步使用表達(dá)RPDase的重組大腸桿菌細(xì)胞進(jìn)行全細(xì)胞光生物催化。RPDase在活細(xì)胞條件中能同時利用內(nèi)源的NADPH和外源的甲酸鈉實現(xiàn)芳香鹵化物的脫鹵氫化。該研究結(jié)果表明,含有非天然光催化劑的人工光生物催化有望成為廉價易得的化學(xué)原料高值化轉(zhuǎn)化的細(xì)胞工廠(圖4)。
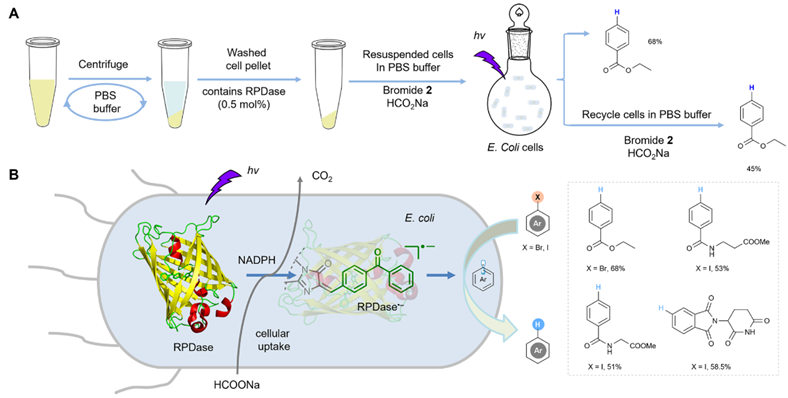
圖4.全細(xì)胞光生物催化脫鹵還原
該工作由華中科技大學(xué)和中國科學(xué)院生物物理研究所合作完成。華中科技大學(xué)鐘芳銳教授和生物物理研究所王江云研究員為本文的共同通訊作者,華中科技大學(xué)和深圳技術(shù)大學(xué)聯(lián)合博士后付雨博士和生物物理研究所劉曉紅研究員為本文共同第一作者。華中科技大學(xué)為第一作者單位。該研究得到科技部重點研發(fā)計劃、國家自然科學(xué)基金委、中國博士后科學(xué)基金面上項目的經(jīng)費支持。
文章鏈接:https://www.sciencedirect.com/science/article/pii/S2451929423001250
