近日,國際頂級期刊《美國化學會雜志》(J. Am. Chem. Soc)在線刊發了我院吳鈺周教授的最新研究成果“Chemogenetic Evolution of Diversified Photoenzymes for Enantioselective [2 + 2] Cycloadditions in Whole Cells” (DOI: 10.1021/jacs.4c03087)。

酶是綠色、高效的生物催化劑,其三維超分子空腔為有機反應的精確選擇性控制提供了一個天然的手性環境,在處理光化學反應中生成的高活性、短壽命的自由基中間體時,這種優勢尤為明顯。然而,自然界中的天然光酶種類十分稀缺且催化性能專一性較強,難以滿足當前不對稱光催化合成的需求。隨著基因工程、蛋白質工程等生物技術的發展,通過將合成化學發展的光催化劑和光催化機制融合到天然蛋白骨架中構建新型人工光酶,極大地拓展了光生物催化的反應類型和應用范圍。近來,吳鈺周教授團隊基于基因密碼子擴展技術將二苯甲酮非天然氨基酸引入至蛋白骨架中構建三重態手性人工光酶的研究,成功展示了人工光酶在不對稱光生物轉化方面的應用潛力(Nature, 2022, 611, 715),但基因密碼子拓展技術僅適用于構建含特定光敏基團的人工光酶,難以用于高效地篩選大量不同的光敏基團,對引入過渡金屬或者結構復雜的有機光敏基團也有較大挑戰。相較之下,蛋白質化學修飾技術可以將不同類型的有機光敏劑定點引入至蛋白骨架中發展多樣性的人工光酶,但由于難以結合高通量的定向進化過程,至今尚未應用于不對稱催化領域。
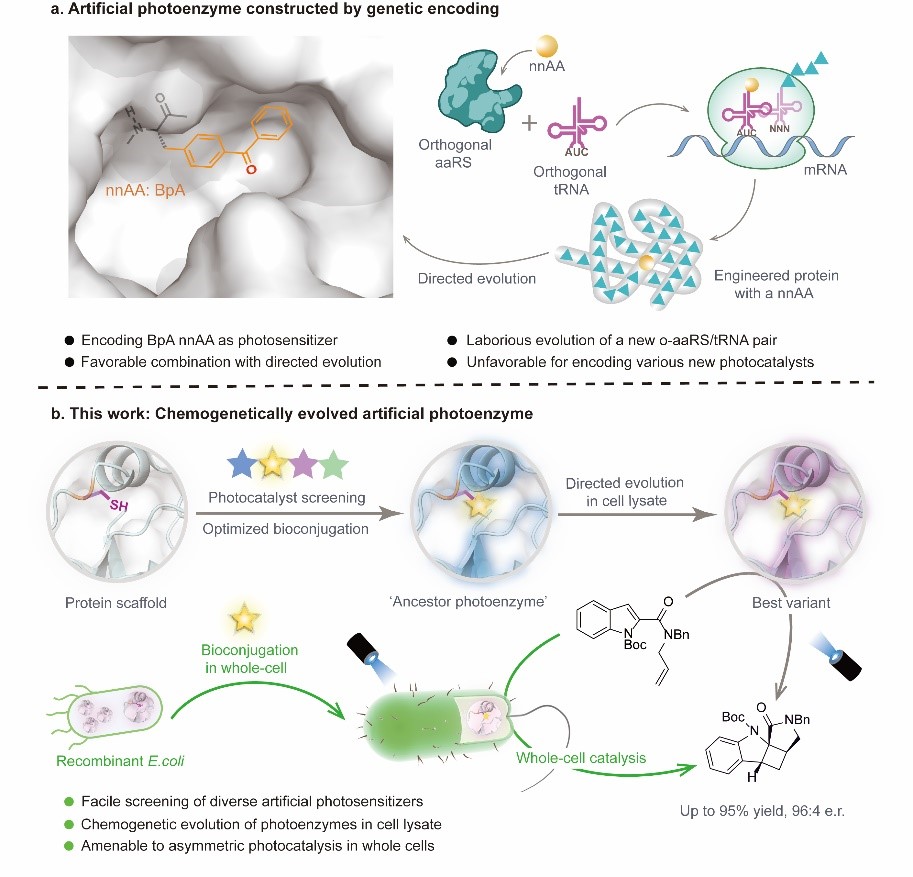
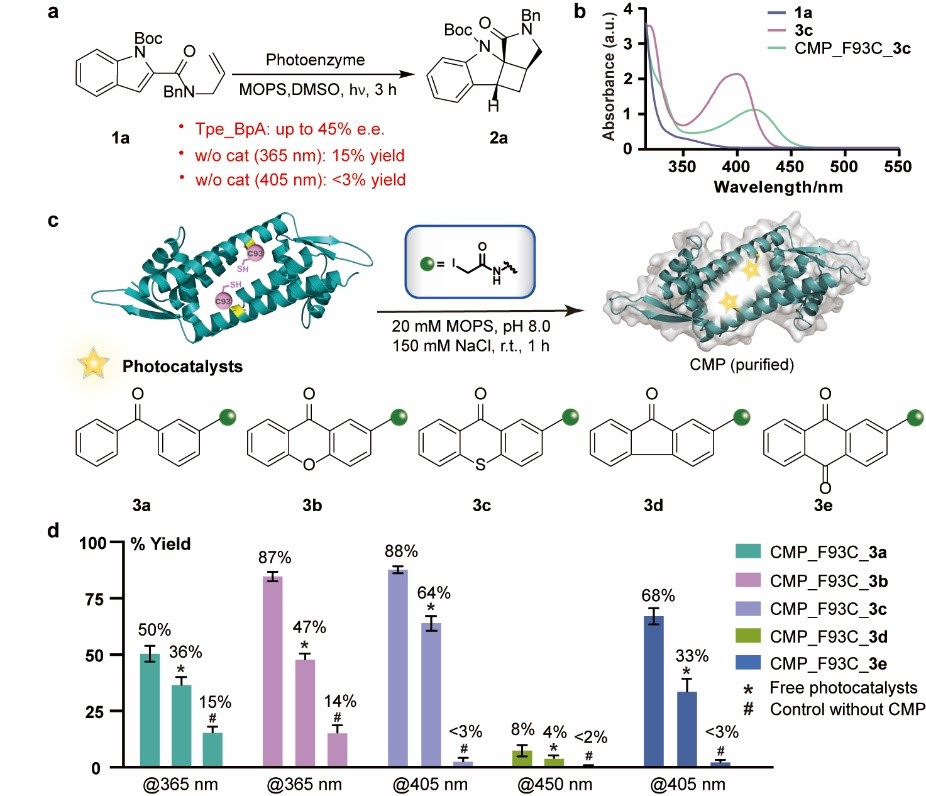
在本文中,吳鈺周教授團隊提出了一種蛋白質化學遺傳修飾的方法,適用于構建結構、性質以及功能各異的手性人工光酶,為激發態光反應的手性控制難題提供了新的解決方案。團隊首先利用蛋白半胱氨酸巰基官能團較強的親核性,將合成化學發展的各類高效有機光敏劑定點插入到選定蛋白的手性空腔中,構建了化學修飾的人工光酶酶庫CMP。由于這類有機光敏劑均具有優異的三重態光物理性質且發色團吸收范圍涵蓋廣,該光酶酶庫能夠在不同工作波長下催化底物從分子基態躍遷到激發態發生光反應,其中含噻噸酮光敏中心的CMP1.0被鑒定為催化紫外敏感型底物2-羧基酰胺吲哚烯基不對稱[2+2]光環加成反應的最佳初代人工光酶。
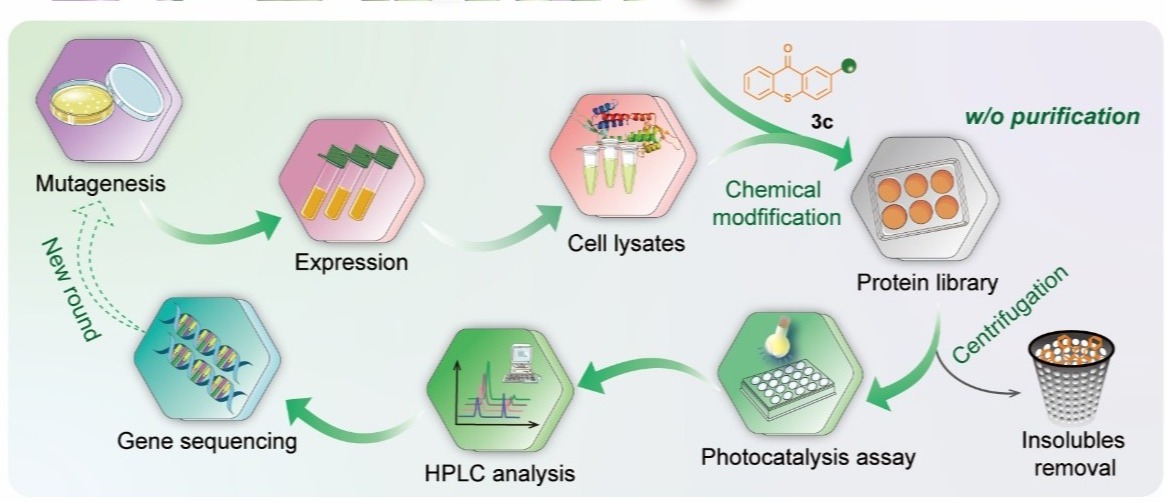
通過探究和優化化學修人工光酶的高效定向進化方法,團隊建立了可以基于細胞裂解液進行蛋白質定點化學修飾的突變體篩選流程,無需經過分離純化,即可進行高通量定向進化。最終經四輪突變迭代優化CMP1.0的氨基酸殘基和反應空腔結構,獲得具有優異催化性能的突變體CMP4.0,該人工光酶能夠高效催化烯基吲哚分子內[2+2]光環加成反應,所獲得的環丁烷吲哚啉產物具有較好的底物普適性和優異的對映選擇性(最高可以獲得96:4 e.r.值)。經CMP4.0晶體結構解析及計算輔助蛋白質模擬分析,闡明了反應優異的對映選擇性來源于光敏基團和周邊關鍵氨基酸殘基與底物之間形成的π-π堆積等多重弱鍵協同作用。
基于CMP4.0優異催化性能及可見光吸收特性,團隊進一步使用表達CMP4.0的重組大腸桿菌細胞探索了全細胞光生物催化,實現了化學遺傳修飾法構建的人工光酶于胞內催化高效對映選擇性光環加成反應,是人工光酶在全細胞不對稱光催化方向的突破性進展,展示了基于化學遺傳修飾法構建人工光合成細胞的可能。這項研究發展了高效的人工光酶構建策略,將從根本上豐富人工光酶的種類,為解決能量轉移不對稱光催化反應中的手性控制難題以及拓寬不對稱光生物催化反應性提供了新的方案,也為發展其他含非天然輔因子的新型高效人工光酶提供了研究基礎。
我院吳鈺周教授為本文通訊作者。我院2020級博士研究生郭娟為論文第一作者,華中科技大學為唯一通訊單位。該研究工作得到了國家重點研發計劃項目(2018YFA0903500)資助。
